成都中医药大学中医药创新研究院/交叉学科研究院药用植物活性天然产物发现与生物合成团队提出基于合成生物学技术的紫杉醇“从头合成”路线图,为破解这一重要抗癌药物的资源瓶颈与可持续生产难题提供了清晰的理论框架与极具前景的解决方案。相关成果以“A synthetic biology roadmap for sustainable production of the plant-originated anti-cancer drug paclitaxel”为题发表在《Trends in Biotechnology》(《Cell》子刊,中科院一区,TOP期刊)上。我校引进人才谭春林副教授为第一作者,刘燕教授和黎胜红教授为共同通讯作者。

紫杉醇(Paclitaxel,商品名Taxol®)是来源于红豆杉属(Taxus)植物树皮的天然二萜类明星药物,因其独特的6/8/6元碳环骨架及复杂的氧化修饰结构,在乳腺癌、卵巢癌和黑色素瘤等恶性肿瘤的临床治疗中占据不可替代的地位。自2000年以来,紫杉醇便稳居全球最畅销抗癌药物行列,峰值市场规模达20亿美元,临床需求持续增长。然而,紫杉醇在红豆杉树皮中的天然丰度极低(仅为干重的0.001%–0.050%),传统生产模式高度依赖野生红豆杉资源砍伐提取+化学半合成,既导致该濒危物种濒临枯竭、生态破坏严重,又因工艺复杂、前体损耗大,造成生产成本居高不下。因此,开发不依赖植物资源的规模化生物制造新路径,已成为该领域亟待突破的关键挑战。
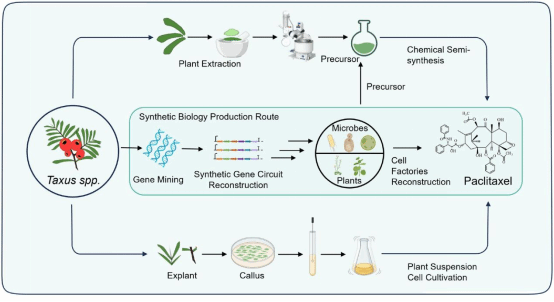
紫杉醇的生物合成途径极为复杂——涉及约19步酶促反应,其中近半数关键氧化步骤由细胞色素P450酶催化。这些来源于植物的P450酶在异源宿主中普遍存在“三大瓶颈”:功能性表达效率低、催化特异性差(产物杂泛性高)、膜整合与辅因子适配不足,导致代谢流从核心前体(如紫杉二烯-5α-醇,Taxadien-5α-ol)向副产物大量分流(如过度氧化产物OCT/iso-OCT)。尽管学界已尝试多种宿主改造,现有研究仍未实现紫杉醇的高效异源从头合成,核心氧化中间体产量远未达到工业化阈值。针对这一核心瓶颈,团队提出“底盘革新+策略协同”的突破路径:如研究团队提出可以采用非经典底盘细胞,如蓝细菌和丝状真菌,利用其独特的膜系统与代谢环境,以增强植物来源P450酶的适配性与功能表达。此外,通过构建人工合成微生物群落,将合成途径模块化分配于不同微生物体系中,可实现跨物种分工协作,提高中间体产量并减轻单菌株代谢负担。
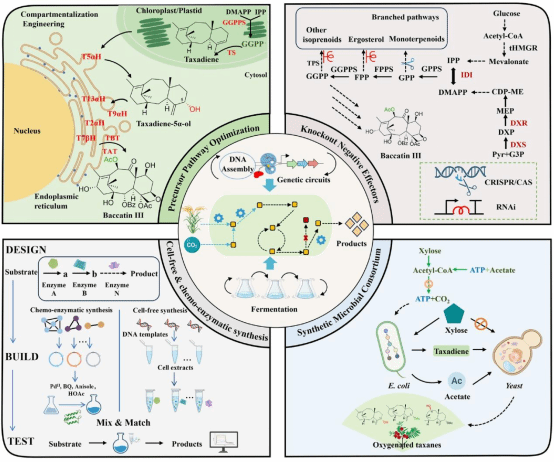
研究团队进一步构建“多策略协同”的技术路线,为紫杉醇生物合成提供系统的解决方案:例如,通过无细胞蛋白合成系统与化学酶法相结合,可有效规避P450酶的催化混杂性及潜在细胞毒性,实现紫杉醇前体的高效合成。同时,引入机器学习(如EVOLVEpro平台)驱动酶工程,定向改造限速酶,指导代谢途径设计与优化,降低副产物生成率。结合CRISPR、RNAi等技术精准调控竞争途径,可有效引导碳代谢流定向富集于目标产物合成途径。目前,这些策略已在本氏烟草、酵母等体系中实现了紫杉醇关键中间体的产量提升,展现出良好的工业化应用潜力。
该研究不仅系统绘制了紫杉醇合成生物学制造的研发路线图,为突破该重要药物生产的资源与环境制约提供了理论指导,也为其他植物源复杂天然产物的可持续生产提供了重要参考。
该研究得到国家重点研发计划(2023YFA0914501)、国家自然科学基金青年科学基金项目(C类)(32400068)、四川省自然科学基金青年科学基金项目(2024NSFSC1833)、中国博士后基金项目(GZC20230332, 2024M750284, 2025T180738)以及四川省博士后创新人才资助项目(BX202318)资助。
全文链接:https://doi.org/10.1016/j.tibtech.2025.11.013
(文、图/中医药创新研究院/交叉学科研究院)